价格:965
货号ROS活性氧检测试剂盒
产品详情
产品详情
产品信息
|
产品名称 |
产品编号 |
规格 |
|
ROS活性氧检测试剂盒 |
HRA1979 |
1000 T |
产品描述
活性氧检测试剂盒是一种利用荧光探针H2DCFDA进行活性氧检测的试剂盒。H2DCFDA本身没有荧光,可以自由穿过细胞膜,进入细胞内后,可以被细胞内的酯酶水解生成DCFH,而DCFH不能通透细胞膜,从而使探针很容易被装载到细胞内。细胞内的活性氧可以氧化无荧光的DCFH生成有荧光的DCF。检测DCF的荧光就可以知道细胞内活性氧的水平。根据活细胞中荧光的产生,可以判断细胞活性氧的含量和变化。用流式细胞仪或荧光显微镜可直接观察,是一种经典的活细胞中活性氧检测方法。
产品特点
本试剂盒提供了活性氧阳性对照试剂Rosup,以便于活性氧的检测。Rosup是一种活性氧阳性诱导药物,浓度为50mg/mL,根据其荧光信号强度,可分析活性氧的实际水平。
本试剂盒本底低,灵敏度高,线性范围宽,使用方便。本试剂盒可以测定1000个样品(以96孔板为标准)。
产品组分
|
组分 |
规格 |
|
H2DCFDA (10mM) |
100 μL |
|
活性氧阳性对照(Rosup,50mg/mL) |
1 mL |
注意事项
1.探针装载后,一定要洗净残余的未进入细胞内的探针,否则会导致背景较高。
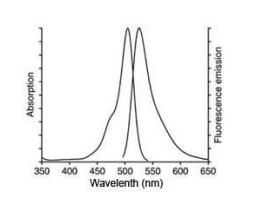
2.探针装载完毕并洗净残余探针后,可以进行激发波长的扫描和发射波长的扫描,以确认探针的装载情况是否良好。DCF的激发光谱和发射光谱请参考下页图谱。
3.尽量缩短探针装载后到测定所用的时间(刺激时间除外),以减少各种可能的误差。
4.荧光酶标仪检测时须使用适合荧光检测的黑板或白板,推荐使用全黑96孔细胞培养板或黑色透明底96孔细胞培养板。
使用方法
一.装载 ROS 探针
1.原位装载探针(仅适用于贴壁细胞)。
(a) 细胞准备:检测前一天进行细胞铺板,确保检测时细胞数量小于 5×105/mL。
(b) 药物诱导:去除细胞培养液,加入适当浓度的药物处理,于 37℃细胞培养箱内避光孵育,实际诱导时间由药物特性和细胞类型决定。
(c) (可选)阳性对照:先用完全培养基等按 1:1000 比例稀释阳性对照(Rosup, 50 mg/mL)到常用工作浓度 50 μg/mL,加入细胞,37℃避光孵育 0.5~4 h,以提高活性氧水平,不同细胞类型存在差异。例如:HeLa 细胞需孵育 30-60 min,MRC5 人胚胎成纤维细胞则需孵育 90 min。
(d) ROS 探针准备:探针装载前按照1:1000用无血清培养液稀释H2DCFDA,使其终浓度为10 μM。
(e) ROS 探针装载:吸除处理药物,加入适当体积稀释好的 H2DCFDA 工作液。加入的体积需充分盖住细胞。例如:6 孔板通常不少于 1000 μL ,对于 96 孔板通常不少于 100 μL 。37℃细胞培养箱内避光孵育 30 min。
(f) 细胞清洗:用无血清培养液洗涤细胞 1~2 次,以充分去除未进入细胞内的 H2DCFDA。
2.收集细胞后装载探针(适用于贴壁细胞和悬浮细胞)
(a) 细胞准备:按照标准方法培养细胞,必须保证检测用的细胞状态。按照适当方法,清洗并收集足量的细胞。
(b) 药物诱导:将收集好的细胞悬浮于适量稀释好的药物,于 37℃细胞培养箱内避光孵育,实际诱导时间由药物特性和细胞类型决定。
(c)(可选)阳性对照:先用无血清培养基稀释阳性对照(Rosup, 50 mg/mL)到常用工作浓度 50 μg/mL,加入细胞,37℃避光孵育 0.5~4 h 以提高活性氧水平,不同细胞类型存在差异。例如:HeLa 细胞需孵育 30-60 min,MRC5 人胚胎成纤维细胞则需孵育 90 min。
(d) ROS 探针准备:探针装载前,按照 1:1000 用无血清培养液稀释 H2DCFDA,使其终浓度为 10 μM。
(e) 探针装载:除去细胞内药物,离心收集细胞,加入稀释好的探针,使其细胞密度为1×106~2×107/mL,37℃细胞培养箱内避光孵育 30 min。
注意:细胞密度需根据后续的检测体系,检测方法,以及检测总量来进行调整。例如:对于流式分析,单管检测内细胞数目不少于 104,也不可多于 106。
(f) 细胞清洗:用无血清细胞培养液洗涤细胞 1-2 次,以充分去除未进入细胞内的H2DCFDA。
二.荧光显微照相操作方法
1.对贴壁生长细胞,可直接在荧光显微镜下观察;对悬浮生长细胞,取 25-50 μL 细胞悬液滴到一张显微载玻片上,再盖上一张盖玻片。
2.荧光显微镜下,选用 FITC 滤光片观察荧光,去除背景观察荧光的变化。
三.流式细胞分析操作方法
1.对贴壁生长细胞,用胰酶消化制备成单细胞悬液;对悬浮生长细胞,直接收集细胞。用 0.5-1 mL PBS 重悬细胞(0.5~1×105/mL)。
2.选择流式细胞仪 FL1 或 BL1 通道,488nm 激发,测定 530nm 的发射,细胞应可分成两个亚群:ROS 阴性细胞仅有很低的荧光强度,ROS 阳性细胞有较强的绿色荧光
四.参数设置
使用 488nm 激发波长,525nm 发射波长,实时或逐时间点检测刺激前后荧光的强弱。DCF的荧光光谱和 FITC 非常相似,可以用 FITC 的参数设置检测 DCF,DCF 的激发光谱和发射光谱参考下图。
运输和保存方法
冰袋运输。-20℃避光保存,尽量避免反复冻融,有效期1年。
注意事项
1)探针装载后,一定要洗净残余的未进入细胞内的探针,否则会导致背景较高。
2)阳性对照Rosup一般使用浓度为100μM(推荐浓度100-400μM,具体依细胞类型而定)。通常刺激后0.5-4h可观察到显著的活性氧水平升高。对于不同的细胞,活性氧阳性对照的效果可能有较大的差别。如果在刺激后30 min内观察不到活性氧的升高,可延长诱导时间或适当提高活性氧阳性对照的浓度。如果活性氧升高得过快,可缩短诱导时间或适当降低活性氧阳性对照的浓度。
3)对于某些特别的细胞,实验过程中如果发现没有刺激的阴性对照细胞荧光也比较强,可以按照1:2000-1:5000稀释H2DCFDA,使H2DCFDA的终浓度为2-5μM,浓度过高容易出现非特异性染色。探针装载的时间也可以根据情况在15-60 min内适当进行调整。
4)活性氧阳性对照(Rosup)仅仅用于作为阳性对照的样品,其他正常实验样品无需加入。
5)探针装载完毕并洗净残余探针后,可以进行激发波长的扫描和发射波长的扫描,以确认探针的装载情况是否良好。DCF的激发光谱和发射光谱请参考上页图谱。
6)尽量缩短探针装载后到测定所用的时间(刺激时间除外),因为探针容易氧化,导致本底荧光值升高,所以建议工作液现用现配,以减少各种可能的误差。
7)如需定量,需要制作标准曲线。通过测定不同浓度的H2O2氧化DCFA的荧光值做标准曲线,X轴为H2O2浓度,y轴是荧光值。根据样品的荧光值即Y值,计算X值即对应的H2O2浓度。
8)实验组荧光值不高可能是因为有的细胞在装载探针后细胞容易漂起来,洗细胞时实验组会吸走一部分细胞。所以在种细胞时可以把细胞量增加一倍,这样细胞紧密连接,贴壁比较牢,实验组的荧光值就高了。
9)为了您的安全和健康,请穿实验服并带一次性手套操作。
10)本产品仅作科研用途!
