价格:1,650
货号Dual Luciferase Reporter Gene Assay Kit 双荧光素酶报告基因检测试剂盒

产品详情
产品详情
产品信息
|
产品名称 |
产品编号 |
规格 |
|
Dual Luciferase Reporter Gene Assay Kit 双荧光素酶报告基因检测试剂盒 |
HRK1208 |
100次 |
|
Dual Luciferase Reporter Gene Assay Kit 双荧光素酶报告基因检测试剂盒 |
HRK1209 |
1000次 |
产品描述
萤火虫萤光素酶(Firefly luciferase)是一种分子量约为61 kDa的蛋白,在ATP、镁离子和氧气存在的条件下,能够催化萤光素(luciferin)氧化成oxyluciferin,在氧化的过程中会发出波长为560 nm左右的生物萤光。海肾萤光素酶(Renilla luciferase)是一种分子量约为36 kDa的蛋白,在氧气存在的条件下,可以催化腔肠素(coelenterazine)氧化成coelenteramide,在氧化的过程中会发出波长为480nm左右的生物荧光。两种生物荧光都可通过化学发光仪进行测定。检测原理如图所示:
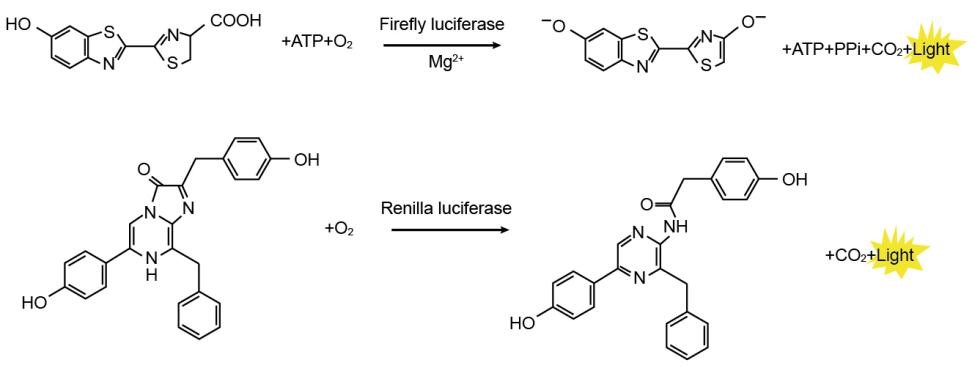
图1:萤火虫和海肾萤光素酶检测原理图
通常将目的基因的5UTR或启动子克隆至Firefly Luciferase的上游,或3UTR克隆至Firefly Luciferase的下游,通过检测萤火虫萤光素酶的量来检测启动子或调控元件的转录调控作用。Renilla Luciferase作为内参,来消除细胞数量、转染效率等的差异。Dual Luciferase Reporter Gene Assay Kit首先以萤光素为底物来检测萤火虫萤光素酶报告基因的活性,之后在淬灭该萤光反应的同时,以腔肠素为底物检测海肾萤光素酶报告基因的活性。该试剂盒具有灵敏度高的特点。
产品组分
|
编号 |
组分 |
产品编号/规格 |
|
|
HRK1208(100T) |
HRK1209(1000T) |
||
|
hrk1208-A |
细胞裂解液 |
60 mL |
60 mL×10 |
|
hrk1208-B |
萤火虫萤光素酶缓冲液 |
10 mL |
10 mL×10 |
|
hrk1208-C |
萤火虫萤光素酶底物(50 ×) |
200 μL |
200 μL×10 |
|
hrk1208-D |
海肾萤光素酶缓冲液 |
10 mL |
10 mL×10 |
|
hrk1208-E |
海肾萤光素酶底物(50 ×) |
200 μL |
200 μL×10 |
运输和保存方式
干冰运输。 -20℃保存,有期限1年。
萤火虫萤光素酶反应工作液和海肾萤光素酶反应工作液现配现用,且不能反复冻融,建议分装-20℃或-80℃保存。
实验步骤
I.前处理
1.细胞
1)构建相应的载体。
2)转染步骤请参照相关的说明书。
3)将细胞裂解液充分混匀,按如下方式加入细胞裂解液,充分裂解细胞。
a: 对于贴壁细胞,吸尽细胞培养液,按照下表比例加入细胞裂解液,轻轻旋转培养皿或者培养板使裂解液完全覆盖细胞;
b: 对于悬浮细胞,离心弃去上清,按照下表比例加入裂解液。
|
细胞培养板 |
96孔板 |
48孔板 |
24孔板 |
12孔板 |
6孔板 |
|
裂解液加入量 |
100 μL |
150 μL |
200 μL |
300 μL |
500 μL |
4)孵育5 min,充分裂解细胞。
【注】:裂解产物可室温保存6 h,4℃保存16 h,-80℃可长期存放。(裂解产物不能多次反复冻融)。
5)(选作)10000-16000 rpm离心1 min,取上清。
2.叶片组织(以烟草叶片为例,仅供参考)
1)构建相应的载体。
2)挑取转化有重组质粒的农杆菌单菌落,接种到2 mL LB液体培养基(添加相应抗生素)中,28℃ 220 rpm培养过夜。
3)农杆菌培养至OD600为1.0,1700× g离心5 min收集菌体后,用1/2MS液体培养基清洗菌体2次;用含有150 μmol/L乙酰丁香酮的1/2MS液体培养基将农杆菌的OD600调至1.0。
4)将待检测的农杆菌菌液进行混合,使每种菌液的OD600为0.5。
5)选取生长期为1个月左右完全伸展的烟草叶片,将混合好的菌液用1 mL注射器(去掉针头)从烟草叶背面进行注射。为保证实验结果的一致性,需要将对照载体和待检测目标载体的菌液注射在同一叶片的不同部位上, 以保证相同的生长背景。
6)正常温室生长条件下,24-48 h即可取样观察。
7)取3-4片直径为6-8 mm的叶盘,放入2 mL的EP管(提前放入3-4个小钢珠)中,液氮中冷冻,使用破碎仪进行研磨破碎(45 Hz,30 s)。破碎完全后在EP管中加入100 μL裂解液。
8)冰上孵育5 min左右,充分裂解叶片。
9)10000-16000 rpm离心1 min,取上清。
3.原生质体(仅供参考)
1)构建相应的载体。
2)制备原生质体。
3)在2 mL EP管中加入相应的载体(加入量需要摸索),加入100 μL原生质体悬浮液。轻摇混匀后,加入110 μL PEG-CaCl2溶液,轻弹混匀。在室温放置10-15 min。
4)加入440 μL W5溶液,上下颠倒以停止转化。
5)200 × g 室温离心5 min,弃去上清,加入800 μL WI溶液重悬原生质体。
6)室温避光培养16-24 h。
7)将原生质体加入2 mL离心管中,离心收集原生质体,加入100 μL左右的裂解液。
8)冰上孵育5 min左右,充分裂解原生质体。
9)(选做)10000-16000 rpm离心1 min,取上清。
II.荧光检测
1)取20 μL裂解液,加至培养板中。按照实验需要,可设置3孔-5孔重复。
2)配制萤火虫萤光素酶反应工作液和海肾萤光素酶反应液,即萤火虫萤光素酶底物(50 ×)和海肾萤光素酶底物(50 ×)
分别用对应的缓冲液稀释至1 ×工作液。并孵育至室温。
3)加入100 μL萤火虫萤光素酶反应液,震板混匀,检测萤火虫萤光素酶的活力,检测尽量在30 min内完成。
4)加入100 μL海肾萤光素酶反应液,震板混匀,检测海肾萤光素酶的活力,检测尽量在30 min内完成。
5)分析数据。
①实验设计:根据不同实验目的,在每个培养板中都应设置对照组、实验组和空白对照组。为了保证实验准确性,理论上每个实验组(包括对照组)都应当减去空白对照组的萤火虫和海肾萤光素酶的发光测量值。
a.空白对照组:
背景F:未转染细胞+萤火虫萤光素酶检测试剂。
背景R:未转染细胞+萤火虫萤光素酶检测试剂+海肾萤光素酶检测试剂。
注:空白对照组的样品量必须与实验样品量相同,包含与实验样品相同的培养基/血清组合,并加上完全相同的检测试剂。
b.实验组:转染细胞经实验化合物处理(即实验组F和实验组R)。
c.对照组:转染细胞不经处理,用以标准化结果(即对照组F和对照组R)。
②计算结果:
实验组比值=(实验组F-背景F)/(实验组R-背景R)。
对照组比值=(对照组F-背景F)/(对照组R-背景R)。
表达倍数=实验组比值/对照组比值。

图2:细胞样品萤火虫和海肾萤光素酶检测流程图
注意事项
1)检测过程中需自备耗材和设备包括如下:PBS;100 μL移液器或者排枪;不透光白色酶标板;Luminometer发光计、多功能酶标仪或者其他能够检测生物发光的仪器;
2)反应温度:酶促反应对温度较为敏感,加样检测前务必将所有试剂平衡至室温(20-25℃)再使用;
3)检测仪器:能检测化学发光的仪器都适用,但由于不同仪器的设置和灵敏度不同,测得的光信号值也会不同;
4)检测设置:Luminescence,350-700 nm,建议检测时间设为2-10 sec;
5)检测板:为防止孔间干扰,推荐使用不透光白色酶标板。黑色酶标板也可用,但因黑色会吸收光信号,可能会降低信号;
6)单管荧光测定仪测定,每个样品与测定试剂混合后到测定前的时间应保持一致;
7)E组分海肾萤光素酶底物易挥发,注意密封保存;
8)为了您的安全和健康,请穿实验服并戴一次性手套;
9)本产品仅作科研用途!
